09.25 2025
近年来,基于诱导多能干细胞(iPSC)的三维脑类器官(brain organoids)技术为研究人类大脑发育和疾病提供了新的平台。然而,现有的类器官模型多数缺乏免疫细胞成分,尤其是小胶质细胞(microglia)——中枢神经系统中最主要的免疫细胞,其在髓鞘清除和再生中扮演关键角色。
2025年9月10日,一篇发表在《Science Translational Medicine》上的研究首次成功构建了包含小胶质细胞的人类髓鞘化脑类器官模型(MHBOs +MG),为研究人类髓鞘修复和药物筛选提供了强有力的工具。
实验结果
1. 构建含小胶质细胞的髓鞘化脑类器官(MHBOs +MG)
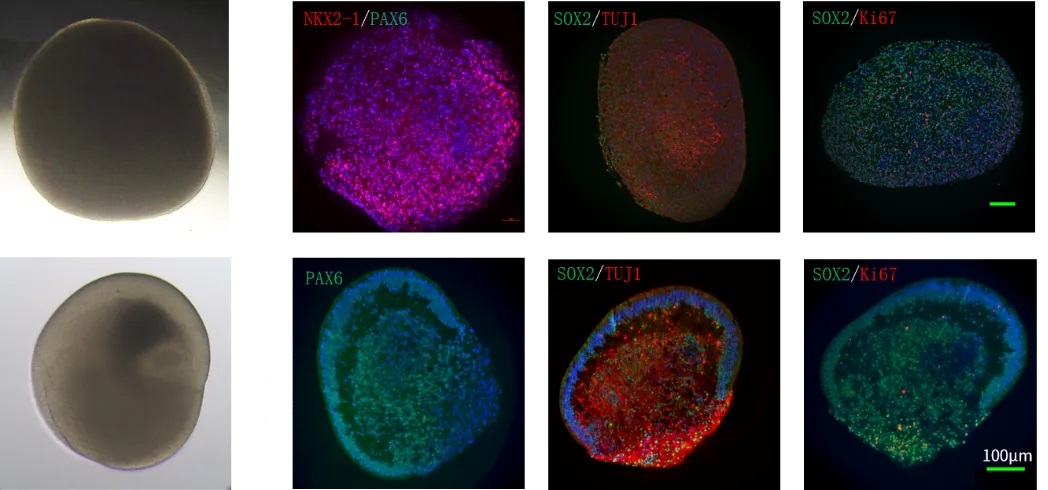
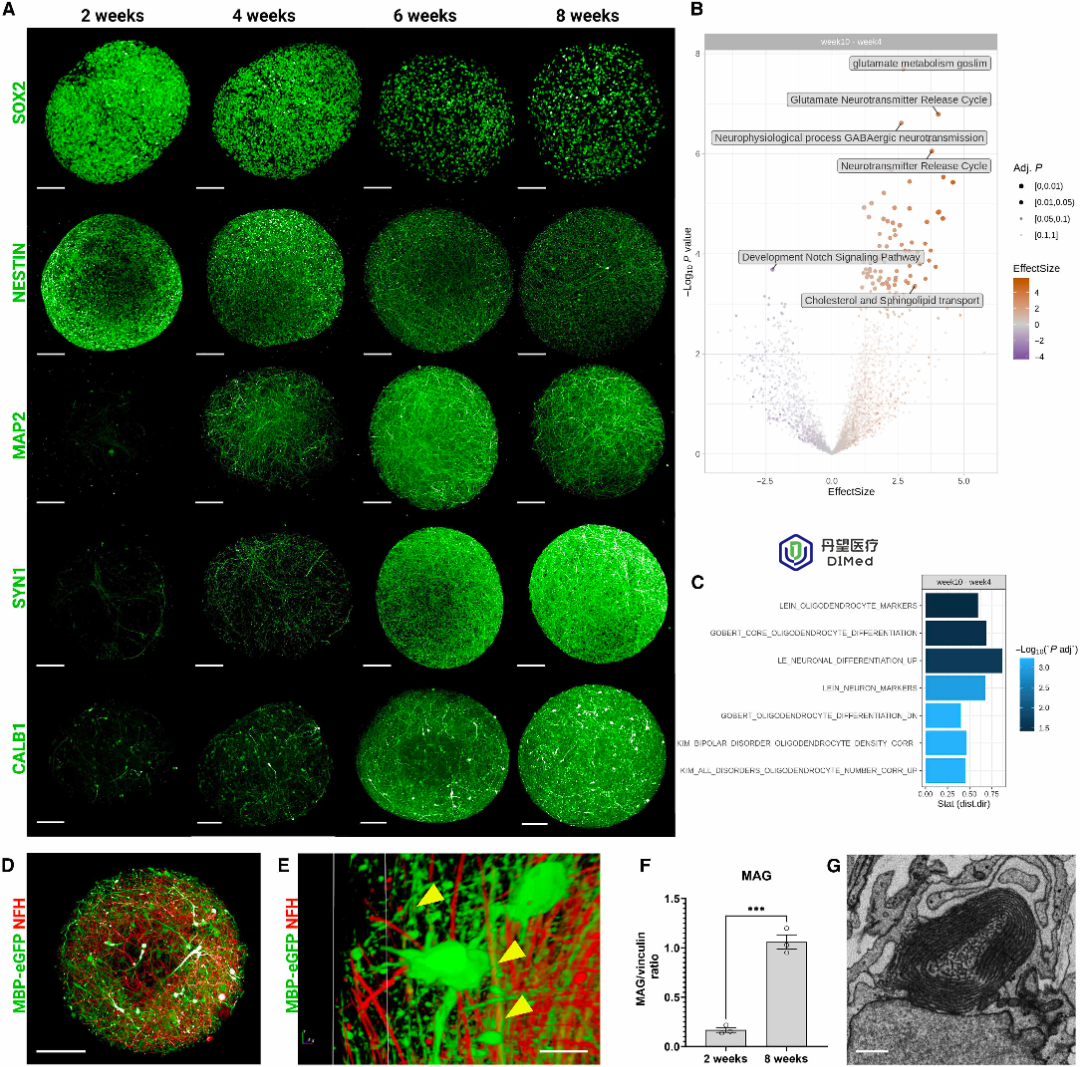
研究者先将人类iPSC衍生的神经干细胞在三维培养中分化培养,多轮培养8周后形成包含神经元、星形胶质细胞和成熟少突胶质细胞的脑类器官。8–10周成熟时,类器官中可检测到髓鞘标志蛋白(如MAG)增加,电子显微镜显示轴突被致密的髓鞘层包裹。
随后,研究者将iPSC分化得到的原始小胶质前体(PreMACs,表达CD14⁺/CD16⁺/CD11B⁺/CD68⁺)接种到已髓鞘化的脑类器官中,使其成熟为小胶质细胞(MG),从而得到含有神经元、星形胶质、髓鞘少突胶质和小胶质细胞的“髓鞘化人类脑类器官”模型(MHBOs+MG)。
MHBOs在分化过程中的特性表征
2. LPC诱导的脱髓鞘与再髓鞘实验
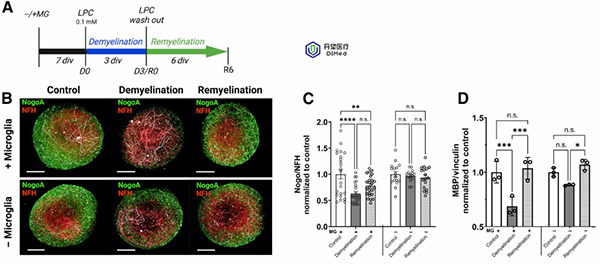
在MHBOs和MHBOs+MG中应用0.1 mM磷脂酰胆碱(LPC)处理3天以诱导去髓鞘,然后换新培养基继续培养6天。免疫荧光标记显示,只有含小胶质的MHBOs+MG组在LPC作用后髓鞘覆盖显著下降,随后自行恢复,再髓鞘阶段髓鞘水平回升。不含小胶质的MHBOs组则几乎未见去髓鞘变化,且仅有极少再髓鞘恢复。若无小胶质细胞,脱髓鞘和再生过程均无法有效进行。
小胶质细胞是髓鞘清除与再生的关键
蛋白质含量定量验证:MHBOs+MG经LPC处理后髓鞘基本蛋白(MBP)量显著下降,再髓鞘后恢复;而MHBOs组未见明显MBP下降,说明缺乏小胶质时无法有效清除髓鞘并启动修复。
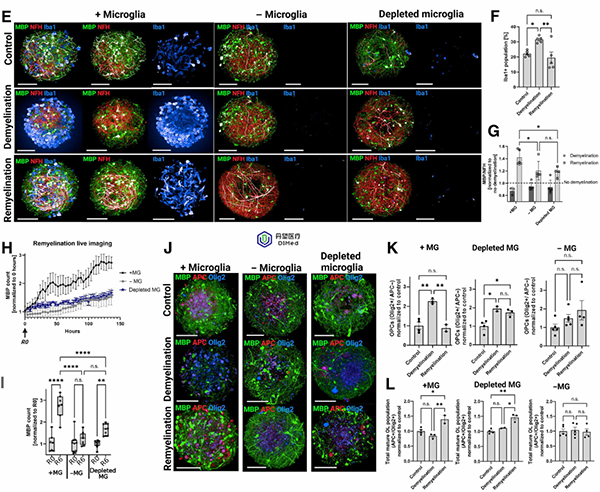
小胶质细胞对人脑类器官中的脱髓鞘、再髓鞘化和少突胶质细胞分化至关重要
脱髓鞘期间,小胶质细胞转变为阿米巴样形态,吞噬髓鞘碎片;神经丝轻链(NFL)的释放量在脱髓鞘时升高,再生时下降,提示小胶质细胞具有清除轴突碎片的功能。这些结果表明,小胶质细胞在清除受损髓鞘碎片并促进髓鞘再生中发挥了关键作用。
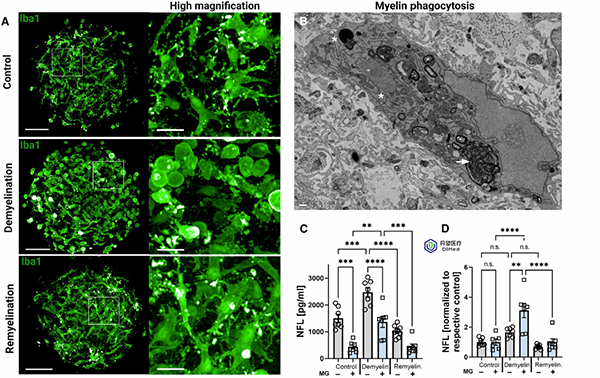
小胶质细胞吞噬功能与炎症调控
3. LPC诱导的脱髓鞘与再髓鞘实验
针对对照、脱髓鞘和再髓鞘阶段的MHBOs+MG和MHBOs进行RNA测序和蛋白组分析,结果显示,脱髓鞘期与髓鞘合成相关的胆固醇代谢通路基因(如HMGCR、FDPS等)普遍下调;而再髓鞘期这些基因表达回升,在MHBOs+MG中更为明显,提示髓鞘膜脂合成被重新激活。同时,小胶质活化标志基因(如TREM2、LGMN)在去髓鞘阶段显著上调,再髓鞘阶段下降,反映出小胶质从促炎状态向修复状态的转变。与此相符,蛋白质组学分析发现再髓鞘阶段成熟少突胶质蛋白(如CNPase、APC、MBP)含量增加,表明有更多成熟OL参与新髓鞘形成。此外,还鉴定到与脂质代谢和维生素A信号相关的关键基因(如RXRA、CPT1A、ACACB)在不同阶段出现表达变化,提示脂代谢途径在髓鞘修复中具有重要作用。
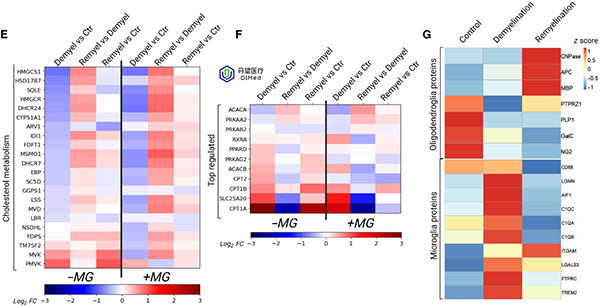
小胶质细胞参与脂质重组过程
4. 促再髓鞘药物测试
研究团队挑选了三个已知有促进髓鞘作用的化合物:第一代抗组胺药物Clemastine(克利马司汀)、Wnt信号抑制剂XAV939和内皮素受体激动剂BQ3020。在LPC去髓鞘后的MHBOs+MG中添加这些药物后,髓鞘再生显著增强——与DMSO对照相比,髓鞘覆盖面积显著增加。而在缺乏小胶质的MHBOs(无MG)中,同样处理未能提高再髓鞘水平。为了验证这一发现的可迁移性,研究者还在小鼠小脑切片模型中进行了对照实验:同样的药物在切片模型中也显著促进了髓鞘的重新形成。这些结果表明,该人类MHBOs+MG模型可以用于评价和筛选促进髓鞘修复的药物。
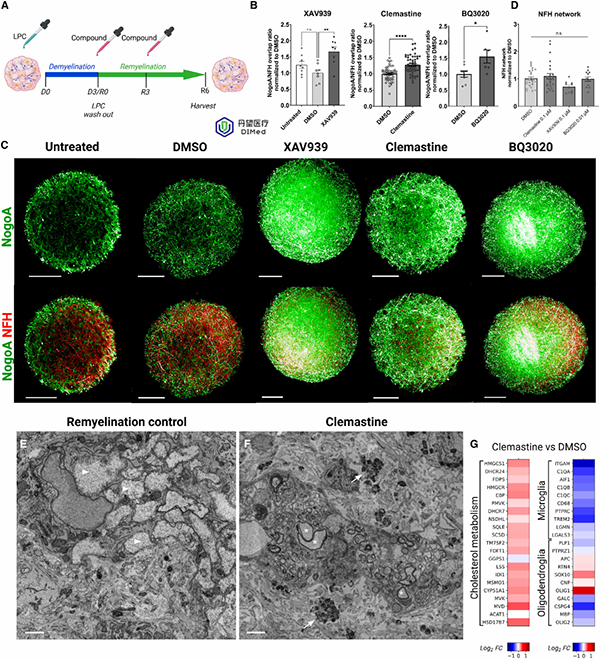
促髓鞘化化合物可增强含小胶质细胞的脱髓鞘脑类器官中的再髓鞘化过程
总结与展望
与传统动物模型相比,此MHBOs+MG模型直接采用人类细胞,在一定程度上反映了人脑髓鞘生物学的特征。研究表明,该模型在诱导去髓鞘、观察小胶质响应及促进再髓鞘等方面与体内和体外(小鼠切片)结果高度一致,证明了其跨物种的转化相关性。因此,这一模型为研究人类髓鞘形成与修复机制提供了新平台,也为筛选和评估治疗脱髓鞘疾病的候选药物提供了可行的人体内前期验证体系。
尽管该模型具有独特优势,但仍存在局限。目前MHBOs+MG是简化版的人脑模型,缺乏完整的血管系统和血脑屏障等结构,也不包含外周免疫成分。此外,类器官的成熟度有限,尚难以完全模拟成年人大脑的复杂微环境。未来研究可通过引入血管化培养、共培养多种细胞类型或利用生物打印等技术进一步完善模型,以更好地模拟人体神经系统的真实结构和功能。
总之,本文描述的髓鞘化人类脑类器官+小胶质(MHBOs+MG)模型为研究人类脱髓鞘病理和髓鞘修复提供了强大工具,有望加速新型再髓鞘疗法的发现和评价。
References
Lange, S., Ebeling, M., Loye, A., Wanke, F., Siebourg-Polster, J., Sudharshan, T.J., Völlmy, F., Kralik, J., Vidal, B., Hahn, K. and Foo, L.C., 2025. Human myelinated brain organoids with integrated microglia as a model for myelin repair and remyelinating therapies. Science Translational Medicine, 17(815), p.eadp7047.
丹望医疗人脑类器官模型:丹望医疗已搭建起成熟且稳定的组织来源的人脑类器官平台,能够高度模拟人脑早期发育的微环境,并形成具有功能性的神经元网络和突触连接。为药物研发与神经毒性、人脑发育与进化、疾病建模与机制研究、再生医学与修复、脑肿瘤等多种研究提供了高灵敏平台。